Todos hemos oido hablar de los minerales o cristales naturales. Los encontramos a diario sin necesidad de acudir a un museo. Una roca y una montaña están constituidos por minerales tan cristalinos como el azucar de un terrón, un trozo de porcelana o el oro de un anillo. Sin embargo, sólo en ocasiones el tamaño de los cristales es lo suficientemente grande para llamar nuestra atención, como es el caso de estos bonitos ejemplares:

Diamante (carbono puro) |

Escapolita (silicato de Al ...) |

Pirita (sulfuro de hierro) |
Imágenes propiedad de Amethyst Galleries, Inc. Sólo se permite su uso para fines educacionales.
Otras imágenes excelentes de minerales se pueden encontrar aquí. |
Los griegos llamaron cristal al cuarzo, krustallos (frio + goteo), es decir, carámbanos de extraordinaria dureza y muy frios. Pero la formación de cristales no es exclusiva de los minerales y los encontramos también, aunque no necesariamente de modo natural, en los compuestos llamados orgánicos, e incluso en los ácidos nucléicos y las proteínas.
El estado cristalino de la materia es el de mayor orden, es decir, donde las correlaciones internas son mayores y a mayor rango de distancias. Y esto se refleja en sus propiedades que son anisotrópicas y discontínuas. Suelen aparecer como entidades puras, homogéneas y con formas geométricas definidas (hábitos) cuando están bien formados. Sin embargo, aquí una vez más, el hábito no hace al monje y su morfología externa no es suficiente para evaluar la denominada cristalinidad de un material.
Con todo ello, nos preguntamos, ¿cuál es la peculiaridad que diferencia a los cristales de otros tipos de materiales?. Pues bien, la denominada estructura cristalina está caracterizada microscópicamente por la agrupación de iones, átomos o moléculas según un modelo de repetición periódica, y el concepto de periodicidad es sencillo de entender si pensamos en los motivos de una alfombra oriental, dibujos de la Alhambra, una formación de tipo militar ...
Si nos fijamos con detenimiento, en estos dibujos hay siempre una fracción de los mismos que se repite. Pues bien, en los cristales, los átomos, los iones o las moléculas se empaquetan dando lugar a motivos que se repiten desde cada 5 Angstrom hasta las centenas de Angstrom (1 Angstrom = 10-8 cm), y a esa repetitividad, en tres dimensiones, la denominamos red cristalina. El conjunto que se repite, por traslación ordenada, genera toda la red (todo el cristal) y lo denominamos celdilla elemental o unidad. Para generalizar, su contenido (átomos, moléculas, iones), o sea el motivo que se repite, puede describirse por un punto (el punto reticular) que representa a todos y cada uno de los constituyentes del motivo. Por ejemplo, cada soldado sería un punto reticular. En la materia condensada, un monocristal es un dominio, generalmente poliédrico, de un medio cristalino.
Pero hay ocasiones en las que la repetitividad se rompe, no es exacta, y precisamente esa característica es lo que diferencia a los cristales de los vidrios o en general de los llamados materiales amorfos (desordenados o poco ordenados).
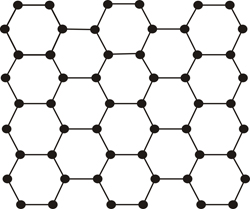
Modelo atómico en un material ordenado (cristal) |
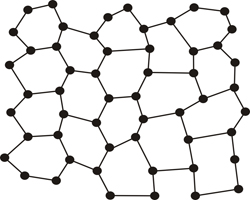
Modelo atómico de un vidrio |
Sin embargo la materia no es totalmente ordenada o desordenada (cristalina o no cristalina) y nos podemos encontrar con toda una degradación contínua del orden (grados de cristalinidad) en los materiales, que nos lleva desde los perfectamente ordenados (cristalinos) hasta los completamente desordenados (amorfos). Esta pérdida gradual de orden que se da en los materiales, es equivalente a lo que podemos observar en los pequeños detalles de esta formación gimnástica, que siendo en cierto modo ordenada, sin embargo hay unas personas con pantalones, otras con falda, con posturas algo distintas o ligeramente desalineados ...
En la estructura cristalina (ordenada) de los materiales inorgánicos, los motivos repetitivos son átomos o iones enlazados entre sí, de modo que generalmente no se distinguen unidades aisladas y de ahí su estabilidad y dureza (cristales iónicos, fundamentalmente)
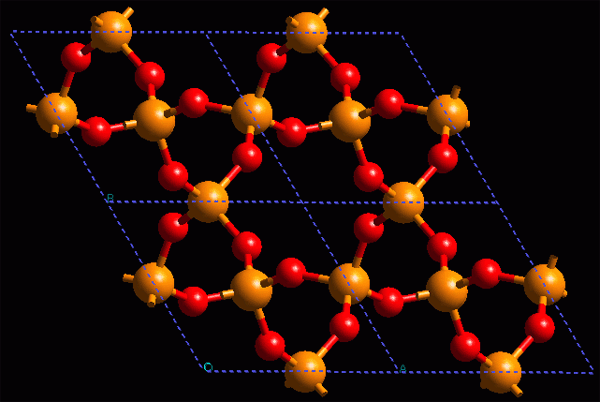
Estructura cristalina de un material inorgánico: el alfa-cuarzo |
Donde sí se distinguen claramente unidades aisladas, es en los llamados materiales orgánicos, en donde aparece el concepto de entidad molecular (molécula), formada por átomos enlazados entre sí, pero en donde la unión entre las moléculas, dentro del cristal, es mucho más débil (cristales moleculares). Son generalmente materiales más blandos e inestables que los inorgánicos.

Estructura cristalina de un material orgánico: cinnamida |
En las proteínas también existen unidades moleculares como en los materiales orgánicos, pero mucho más grandes. Las fuerzas que unen estas moléculas son también similares, pero su empaquetamiento en los cristales deja muchos huecos que se rellenan con agua no ordenada y de ahí su extrema inestabilidad.

Estructura cristalina de una proteína: AtHal3 |
Los distintos modos de empaquetamiento en un cristal dan lugar a las llamadas fases polimórficas (fases alotrópicas para los elementos), que confieren a los cristales (a los materiales) distintas propiedades. Por ejemplo, de todos son conocidas las distintas apariencias y propiedades del elemento químico Carbono, que se presenta en la Naturaleza en dos formas cristalinas muy diferentes, el diamante y el grafito:

Diamante (carbono puro) |

Grafito (carbono puro) |
El grafito es negro, blando y un lubricante excelente, lo que sugiere que sus átomos deben estar distribuidos (empaquetados) de un modo que puedan entenderse sus propiedades. Sin embargo, el diamante es transparente y muy duro, por lo que debe esperarse que sus átomos estén muy fijamente unidos. En efecto, sus estructuras sub-microscópicas (a nivel atómico) dan cuenta de sus diferencias:

Diamante, con estructura muy compacta |

Grafito, con estructura atómica en láminas |
En el diamante, cada átomo de carbono está unido a otros cuatro en forma de una red tridimensional muy compacta (cristales covalentes), de ahí su extrema dureza y su caracter aislante. Sin embargo, en el grafito los átomos de carbono están distribuidos en forma de capas paralelas separadas entre sí mucho más de lo que se separan entre sí los átomos de una misma capa. Debido a esta unión tan debil entre las capas atómicas del grafito, los deslizamientos de unas frente a otras ocurre sin gran esfuerzo, y de ahí su capacidad lubricante, su uso en lapiceros y su utilidad como conductor.
Y, hablando de conductores, en los cristales metálicos los átomos de metal se estructuran de forma que hay electrones deslocalizados que dan cohesión al conjunto y que son responsables de sus propiedades eléctricas.
Hay, obviamente, muchas preguntas que el lector se habrá hecho si ha llegado hasta este punto, y una de las más obvias es: ¿cómo sabemos la estructura de los cristales?. Pero eso será objeto de otros apartados de estas páginas. Le animamos a consultarlas!. 
